II - Son fonctionnement & sa synthèse
1) Le fonctionnement de l'apirine
- a - Les différentes formes galéniques
La forme galénique (ou forme pharmaceutique ou médicamenteuse) est l’aspect physique final du médicament sous forme individuelle comprenant les principes actifs ainsi que les excipients. Beaucoup de variété de formes galéniques existent : comprimé, suppositoire, gélule, poudre, comprimé effervescent, sirop, gouttes, pastille, dragée, crème…
Mais chaques médicaments n’existent pas sous toutes les formes. C’est le cas pour l’aspirine qui existe seulement en comprimés (à action immédiate, à action retardé, effervescents, à croquer, enrobés), en sachets (poudre), en flacons injectables (par voie intraveineuse ou intramusculaire), et en suppositoires.
Les formes galéniques permettent de modifier la vitesse de la libération du principe actif, donc une atténuation de la douleur plus ou moins rapide . Il y a trois formes:
*Formes à libération accélérée: agissent en 15 à 30 minutes
- comprimés sublinguaux, muco-gingivaux, à sucer
*Forme à libération ralentie ou prolongée: permet une durée d’absorption plus longue, donc une durée d’action du principe actif prolongée, et permet alors de réduire le nombre de prise.
- comprimés filmés, osmotiques, pelliculés, capsules avec poudre
*Forme à libération modifiée ( formes retard ). Elle permet, gràce à une modification des conditions de l'absorption digestive de libérer le principe actif à un moment ou un lieu de l'organisme différent:
- forme gastro-résistante: le principe actif est libéré dans un autre lieu que l'estomac ( intestin par exemple ) comme les comprimés et dragées gastro-résistants.
- b - Fonctionnement de la molécule d’aspirine
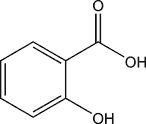
Le médicament n'agit pas de la même manière sur tous les patients: il dépend de l'âge, du sexe, de la condition physique et de sa maladie. L'aspirine ou acide acétylsalicylique est un anti-inflammatoire non-stéroidiens (AINS).
Il agit principalement sur:
- la douleur (action analgésique) :
L'aspirine inhibe des enzymes (les COX1 et 2) qui sont responsables de la production des prostaglandines. Or le seuil de la stimulation des recepteurs de la douleur est abaissé par la production de prostaglandines. Ainsi, en inhibant la production de prostaglandines, on joue sur le seuil de la sensation de la
- la fièvre (action antipyrétique) :
Lors d'une infection, il y a production d'interleukines1 par les macrophages, qui transitent vers l'hypothalamus (régulateur de la température corporelle). L'hypothalamus va alors produire des prostaglandines E2, ce qui va engendrer une augmentation de la température corporelle. L'aspirine agit en réduisant la production de prostaglandines (via l'inhibition d'enzyme COX 1 et 2) dans l'hypothalamus.
- les inflammations
- contre les maladies cardio-vasculaires car elle fluidifie le sang, c'est un anti-agrégant plaquétaire :
Les membranes des plaquettes sanguines sont riches en COX1.
L'aspirine bloque l'enzyme COX1, ce qui empêche la transformation de l'acide arachidonique en thromboxane A2. C'est ce thromboxane A2 qui a un pouvoir pro-agrégant, en l'inhibant, on obtient un effet anti-agrégant.
A très forte dose, il y a un risque d'hémorragie.
La sensation de la douleur est donné par la prostangline ( agents de protection de la paroi gastriqueet des muqueuses intestinales, qui sont produites dans l'organisme par les tissus ) qui va alors permettre au cerveau de ressentir la douleur. L'aspirine va alors empècher cetre production de prostaglandine pour lutter contre les symptômes de douleur, fièvre et inflammation. Après être absorbée ( par voie orale, intraveineuse ou rectale), ele se rend directement dans l'estomac où elle va être absorbée par la muqueuse intestinale et les intestins et est assimilée par la paroie intestinale avant de se transmettre dans le sang. C'est seulement après être passé dans le foie que l'acide acétylsalicylique va atteindre les cellules endommagées en se diffusant dans tout l'organisme pour permettre au cerveau d'être moins sensible à la douleur. Pour cela, l'aspirineva intervenir pour empècher le développement de prostaglandine en inhibant les enzymes appelés Cyclo-oxygénase (COX 1 et 2, qui sont nécessaire au processus de fabrication de l'hormone). Il va alors empècher l'acide arachidonique de rentrer en contact avec les COX et va donc interrompre la chaîne de la prostaglandine et l'empècher d'en fabriquer. C'est pour cela que le cerveau est moins sensible à la substance émise par les cellules, ce qui fait que la douleur est bien moins perçue par le cerveau. Après avoir agit, les molécules d'aspirine sont filtrées par les reins puis éliminées par les urines. L'élimination de l'aspirine est plus ou moins rapide, selon les doses absorbées.
- c - Les formulations de l'aspirine
L'acide aétylsalicylique intervient dans de nombresues préparatins pharmaceutiques. En Françe, plus de 45 médicaments contiennent de l'aspirine.
Or, connu principalement sous la forme la plus imple: en comprimé, il contient généralement 500mG d'acide acétylsalicylique auquel sont ajoutés quelques additifs comme de l'amidon et du gel de silice qui sont des excipients destinés à maintenir la poudre d'acide acétylsalicylique compact. De plus, il ne se dissous pas facilement dans l'eau et son goût acide n'est pas particulièrement agréable ainsi que sa toxicité dans l'estomac qui est due a son acidité. En effet, le taux de ionisation dans l'estomac est très faible en raison du pH des sucs gastriques qui est proche de 1. Sa forme moléculaire "liposoluble" lui permet d'être soluble dans les substances organiques et les graisses. Il passe dans la membrane des cellules de la paroi de l'estomac et une foi dans les cellules, la molécule d'acide acétylsalicylique s'ionise en raison du pH qui es d'environ 7.4 ce qui est bien supérieur au pKa et comme les ions acétylsalicylate ne peuvent pas retraverser la membrane de la cellule vu qu'ils ne sont pas liposolubles, l'aspirine va s'accumuler jusqu'à ce que sa toxicité se manifeste ce qui va faire mourrir la cellule et la lésion apparaît.
Pour vaincre ce probléme de toxicité, de nouveaux comprimés entérosolubles qui se dissoudent dans l'intestin sont fabriqués.
L'acétylsalicylate de lypine a une acidité plus faible que l'aspirine ( plus agréable à avaler) et est très soluble dans l'eau, mais des réactions se produisent au niveau du milieu acide de l'estomac.
L'aspirine effervescent est associé à de l'hydrogénocarbonate de sodium et à de la vitamine C ou acide ascorbique et c'est une des formes les plus utilisées.
2) La synthèse de l'aspirine
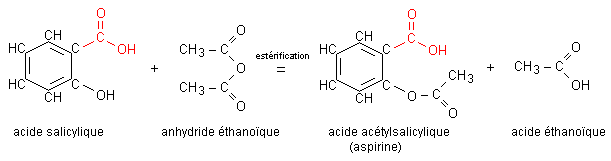
Nous avons réalisé la synthèse de l’acide acétylsalicylique, le principe actif de l’aspirine, à partir d’acide salicylique et d’anhydride éthanoïque.
L’équation de la réaction de la synthèse de l’aspirine s’écrit :
Liste des produits nécessaire :
- de l’acide sulfurique ;
- de l’anhydride éthanoïque ;
- un flacon compte-gouttes d’acide sulfurique ;
- de l’éthanol à 95° ;
- de l’éluant (60% de cyclohexane, 20% d’acide d’éthyle, 20% d’acide acétique) ;
- de l’aspirine du commerce (aspirine du Rhône) ;
- du gros sel ;
- des glaçons / glace pillée.
1) Préparation et cristallisation de l’aspirine
Sous la hotte, nous avons introduit dans un erlenmeyer de 250 mL : 5,0 g d’acide salicylique, 7,0 mL d’anhydride éthanoïque et 5 gouttes d’acide sulfurique concentré. Après avoir installé un réfrigérant à air sur l’erlenmeyer, nous l’avons mis dans un bain-marie à 60°C sur un agitateur magnétique et nous l’avons laissé chauffer 20 minutes.
Nous avons retiré l’erlenmeyer du bain-marie et versé 5 mL d’eau dedans. Quand l’erlenmeyer à refroidit, nous avons ajouté 25 mL d’eau distillée froide et agité à température ambiante pour détruire l’excès d’anhydride éthanoïque et observer le début de la cristallisation. A l’apparition des cristaux, nous avons placé l’erlenmeyer dans un bain d’eau glacée (eau froide + glaçons) environ 10 minutes. Ensuite, pour filtrer les cristaux obtenus, nous avons réalisé une filtration sur Büchner et nous avons s
éché les cristaux entre deux morceaux de papier-filtre. Nous séparons le produit obtenus en deux parties car nous allons réaliser une purification de l’aspirine.
2) Purification de l’aspirine par recristallisation
Dans un erlenmeyer, nous avons dissout progressivement l’aspirine préparée dans 3 mL d’éthanol à 95% en chauffant doucement au bain-marie puis nous avons versé ce mélange dans 10 mL d’eau chaude. Nous avons laissé refroidir l’erlenmeyer à l’air sans l’agiter puis nous l’avons introduit dans un bain d’eau glacée (eau froide + glaçons). Pour purifier l’aspirine, nous avons refait une filtration sur Büchner : le produit obtenus est une poudre blanche.
3) Vérification de la pureté de l’aspirine par CCM (Chromatographie sur Couche Mince)
Tout d’abord, nous avons dissout les deux produits obtenus et l’aspirine du commerce dans de l’eau distillée. Nous avons préparé deux chromatographies : une avec l’aspirine cristallisée et l’autre avec l’aspirine purifiée. Sur chaque plaque à chromatographie, nous avons tracé un trait à 1 cm du bord et placé trois croix à 1 cm d’intervalle environ. Sur la première plaque, nous avons déposé à l’aide de capillaires de l’acide salicylique sur la première croix, l’aspirine synthétisée cristallisée sur la seconde et sur la troisième de l’aspirine du commerce. Sur la seconde plaque, nous avons déposé à l’aide de capillaires de l’acide salicylique sur la première croix, l’aspirine synthétisée purifiée sur la seconde et sur la troisième de l’aspirine du commerce.








/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F1%2F1%2F1166168.jpg)







































/https%3A%2F%2Fstorage.canalblog.com%2F13%2F22%2F1219488%2F93858547_o.jpg)